Что такое клинические исследования?
Это медицинские исследования, которые проводятся, чтобы проверить эффективность и безопасность новых или уже известных лекарственных препаратов или медицинских устройств для лечения определённого заболевания.
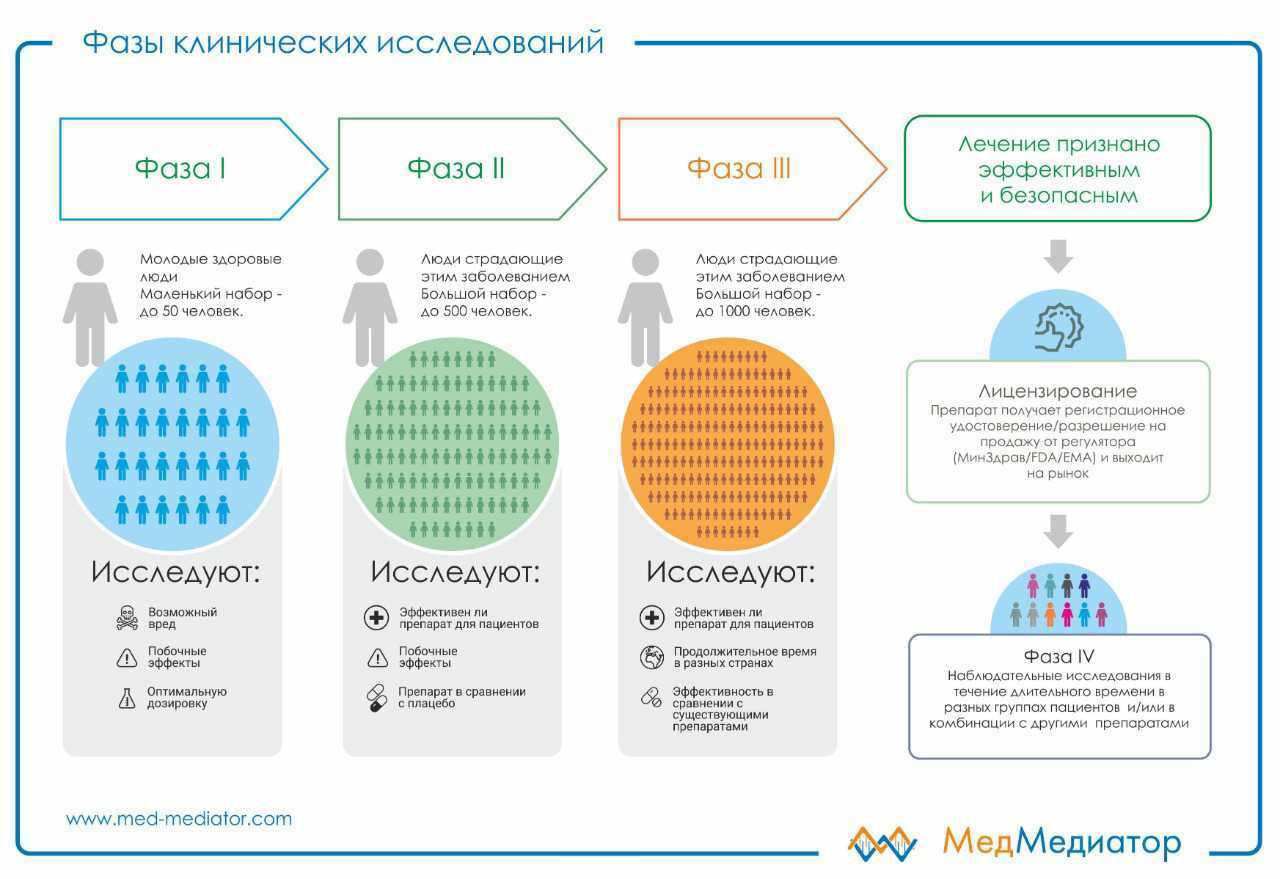
Этапы клинического исследования
В большинстве случаев, чтобы фармацевтическая компания получила разрешение на применение нового препарата в широкой клинической практике, нужны три фазы исследований.I фаза: исследования на небольшом количестве добровольцев (чаще всего, здоровых людях) тестируют безопасность нового препарата и подбирают его оптимальную дозу;
II фаза, где уже участвуют пациенты с определенным заболеванием, для лечения
которого и разрабатывался новый препарат. На этом этапе уже можно говорить об эффективности нового лекарства.
III фаза охватывает большее количество пациентов, часто из разных стран мира. Обычно на этом этапе сравниваются две и более группы пациентов, одна из которых лечится новым препаратом, а другая – уже существующими («золотой стандарт» терапии). Если на момент исследования такого стандарта нет, то допустимо использование плацебо – инъекции или таблетки, в которой нет основного лекарственного вещества. При этом распределение пациентов по группам идет случайным образом и о том, какое лечение (экспериментальное или стандартное) получает пациент не знают ни сам пациент, ни доктор (двойное слепое исследование). Именно такой алгоритм клинического исследования считается самым доказательным с точки зрения убедительности полученных результатов.
Как узнать про клинические исследования по моему заболеванию?
Все клинические исследования в России перечислены в официальном реестре Минздрава России www.grls.rosminzdrav.ru. В нем есть подробная информация о медицинских центрах, в которых данное исследование проводится. На сайте Ассоциации Организаторов Клинических Исследований есть подробная инструкция как пользоваться поиском по реестру: http://acto-russia.org/index.php?option=com_content&task=view&id=310Другим, более полным источником информации по клиническим исследованиям является международный реестр Национального института здоровья США www.clinicaltrials.gov.
Часто клинические исследования, которые идут в Европе, можно найти как на этом сайте, так и на сайте европейского регистра исследований: https://www.clinicaltrialsregister.eu/ctr-search/search.
Третий ресурс, в котором можно посмотреть информацию по текущим исследованиям именно орфанных препаратов – база OrphaNet: https://www.orpha.net/consor/cgi-bin/ResearchTrials_ClinicalTrials.php?lng=EN
Что нужно знать, чтобы принять решение об участии в клиническом исследовании?
1. Это экспериментальное лечение. Вы и Ваш доктор должны убедиться, что все существующие опции испробованы и польза от участия в исследованиях перевешивает существующие риски применения нового лечения.
2. У каждого клинического исследования есть Протокол, в котором подробно описаны все процедуры и условия проведения исследования. Вам необходимо внимательно его прочитать и задать вопросы. Только после этого Вас попросят подписать Информированное согласие, в котором вы соглашаетесь, что понимаете все условия и риски.
3. В любом Протоколе есть критерии включения, невключения и исключения пациентов для участия в исследовании. Это подробное описание диагноза, клинических симптомов, их тяжести у пациента, по которым врач-исследователь принимает решение может ли данный пациент участвовать в исследовании.
4. Исследования проводятся наиболее опытными врачами-исследователями в ведущих медицинских центрах.
Как оценить риски принятия участия в клиническом исследовании?
Участие в клиническом исследовании позволяет Вам получить новое лекарство бесплатно и проходить лечение у лучших специалистов. Но не стоит забывать и о минусах, к которым относятся неописанные побочные явления, побочные расходы, связанные с поездками в медицинский центр, или нахождение в стационаре длительное время. Также присутствует фактор неоправданных надежд на улучшение состояния здоровья, которые вам никто не гарантирует.

